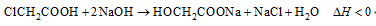2020年江苏高考化学答案解析
1.打赢蓝天保卫战,提高空气质量。下列物质不属于空气污染物的是
答案:B
2.反应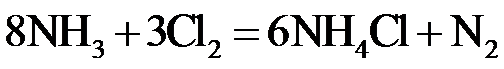 可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是
可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是
答案:C
4.常温下,下列各组离子在指定溶液中能大量共存的是
答案:A
5.实验室以CaCO3为原料,制备CO2并获得CaCl2·6H2O晶体。下列图示装置和原理不能达到实验目的的是
答案:D
6.下列有关化学反应的叙述正确的是
答案:B
7.下列指定反应的离子方程式正确的是
答案:C
8.反应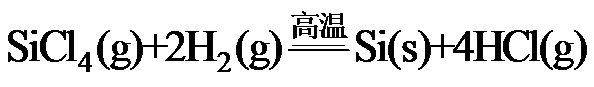 可用于纯硅的制备。下列有关该反应的说法正确的是
可用于纯硅的制备。下列有关该反应的说法正确的是
答案:B
9.下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是
答案:A
11.将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题11图所示的情境中,下列有关说法正确的是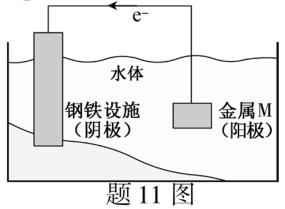
答案:C
12.化合物Z是合成某种抗结核候选药物的重要中间体,可由下列反应制得。 下列有关化合物X、Y和Z的说法正确的是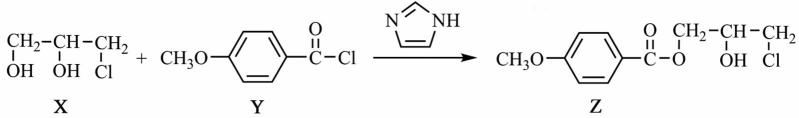
答案:CD
14.室温下,将两种浓度均为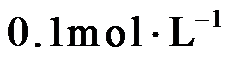 的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
答案:AD
15.CH4与CO2重整生成H2和CO的过程中主要发生下列反应 在恒压、反应物起始物质的量比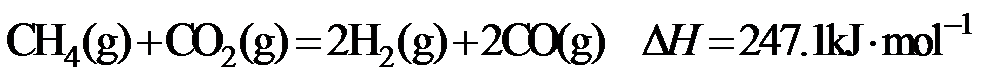
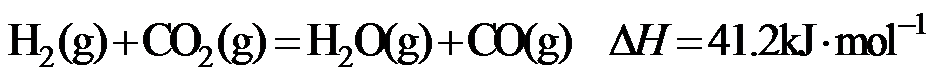
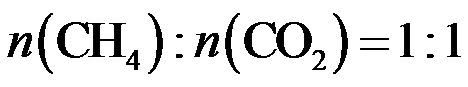 条件下,CH4和CO2的平衡转化率随温度变化的曲线如题15图所示。下列有关说法正确的是
条件下,CH4和CO2的平衡转化率随温度变化的曲线如题15图所示。下列有关说法正确的是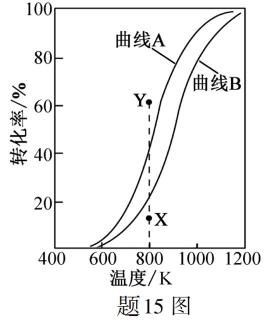
答案:BD

(1)醛基 (酚)羟基
(2)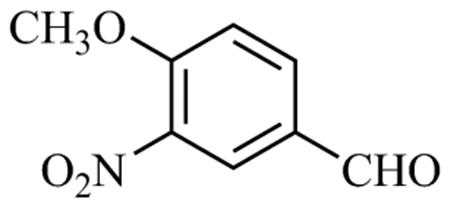
(3)取代反应
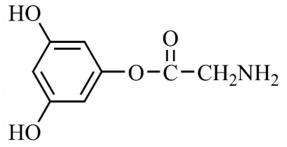
(4)
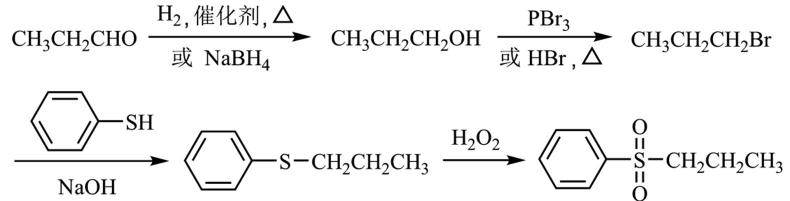
(5)
(1)
NaClO溶液吸收空气中的CO2后产生HClO,HClO见光分解
(2)①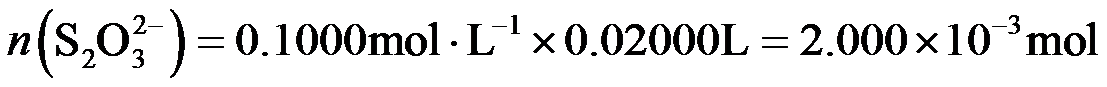
根据物质转换和电子得失守恒关系: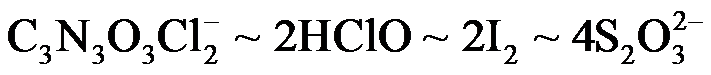
得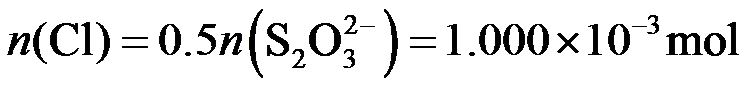
氯元素的质量:
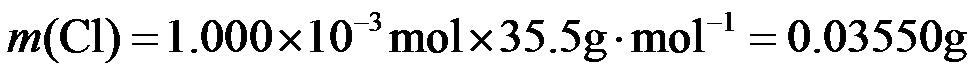
该样品的有效氯为:
该样品的有效氯大于60%,故该样品为优质品
②偏低
(1)AB
(2)H2 取少量清液,向其中滴加几滴KSCN溶液,观察溶液颜色是否呈血红色
(3)pH偏低形成HF,导致溶液中F−浓度减小,CaF2沉淀不完全
(4)①
或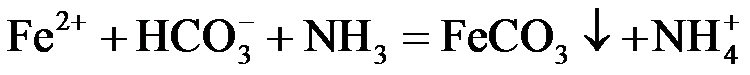
②在搅拌下向FeSO4溶液中缓慢加入氨水−NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀
(1)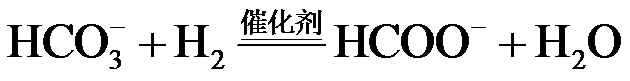
温度升高反应速率增大,温度升高催化剂的活性增强
(2)①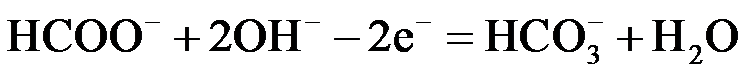 H2SO4
H2SO4
②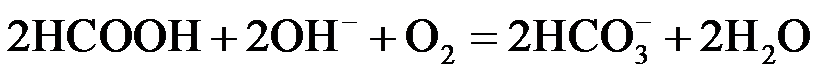 或
或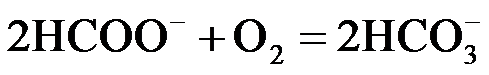
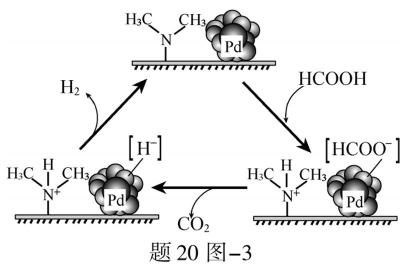
(3)①HD ②提高释放氢气的速率,提高释放出氢气的纯度
第1小题正确答案
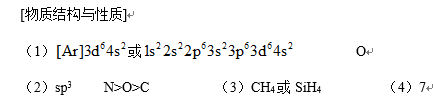
第2小题正确答案
[实验化学]
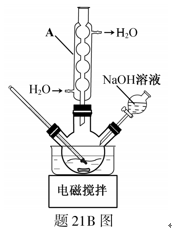
(1)(回流)冷凝管 防止升温太快、控制反应体系pH
(2)防止暴沸 (3)减小 趁热过滤 (4)提高羟基乙酸钠的析出量(产率)
22.羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为 实验步骤如下: 步骤1:如图所示装置的反应瓶中,加入40g氯乙酸、50mL水,搅拌。逐步加入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9。 步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15℃,过滤得粗产品。 步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。 步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。 (1)步骤1中,如图所示的装置中仪器A的名称是___________;逐步加入NaOH溶液的目的是____________。 (2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是_______________。 (3)步骤3中,粗产品溶解于过量水会导致产率__________(填“增大”或“减小”);去除活性炭的操作名称是_______________。 (4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是_______________。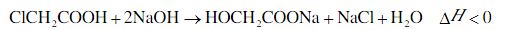
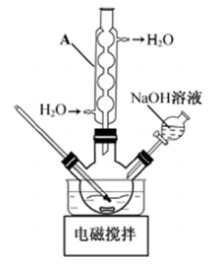
答案:(1). (回流)冷凝管 (2). 防止升温太快、控制反应体系pH (3). 防止暴沸 (4). 减小 (5). 趁热过滤 (6). 提高羟基乙酸钠的析出量(产率)




 的物质的量分数随pH的分布如题16图−1所示。
的物质的量分数随pH的分布如题16图−1所示。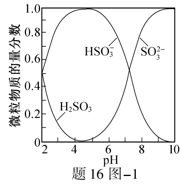

 生成速率越大,其主要原因是 ▲ ;随着氧化的进行,溶液的pH将 ▲ (填“增大”、“减小”或“不变”)。
生成速率越大,其主要原因是 ▲ ;随着氧化的进行,溶液的pH将 ▲ (填“增大”、“减小”或“不变”)。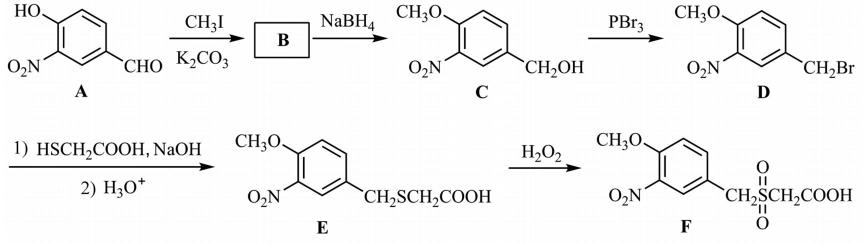
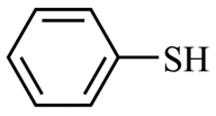 为原料制备
为原料制备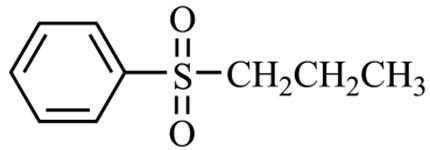 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。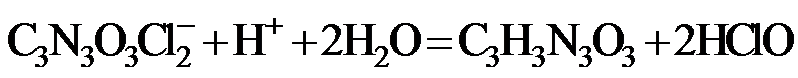
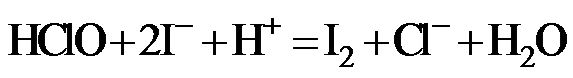
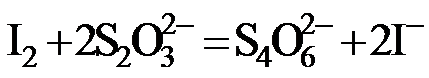
 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00 mL。
Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00 mL。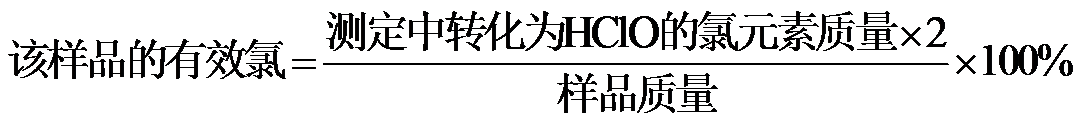 )
)

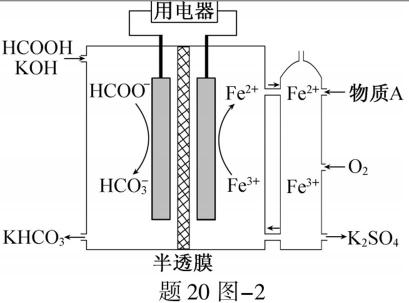
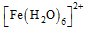 中与Fe2+配位的原子是 ▲ (填元素符号)。
中与Fe2+配位的原子是 ▲ (填元素符号)。